дехидрогенази са ензими, които участват в окислителните процеси. Те се срещат в различни варианти в човешкото тяло и например катализират разграждането на алкохола в черния дроб.
Какво представляват дехидрогеназите?
Дехидрогеназите са специализирани ензими. Биокатализаторите ускоряват естественото окисляване на субстратите. Вещество, което се окислява, губи електрони. При биологични реакции дехидрогеназите отделят водородни аниони от субстрат. Анионите са отрицателно заредени частици.
В този случай водородният атом приема електрон и по този начин получава отрицателен електрически заряд. Действителната реакция протича в активния център на ензима. Когато дехидрогеназата разцепва водородния анион от субстрат, кофакторите поемат електроните и водорода. Кофакторите са молекули, които играят помощна роля в ензимните процеси, но не участват в самото разцепване. Кофакторите на дехидрогенази включват никотинамид аденин динуклеотид (NAD +) и флавин аденин динуклеотид (FAD).
За разлика от дехидрогеназите, дехидратазите отделят цели водни молекули от субстрата си. Дехидрогеназите също могат да причинят противореакцията и да допринесат за намаляване вместо окисляване. По време на редукцията, частица приема електрони, вместо да ги предава. Биологията назначава дехидрогенази на оксидни редуктази. Тези видове ензими съществуват във всеки жив организъм.
Функция, ефект и задачи
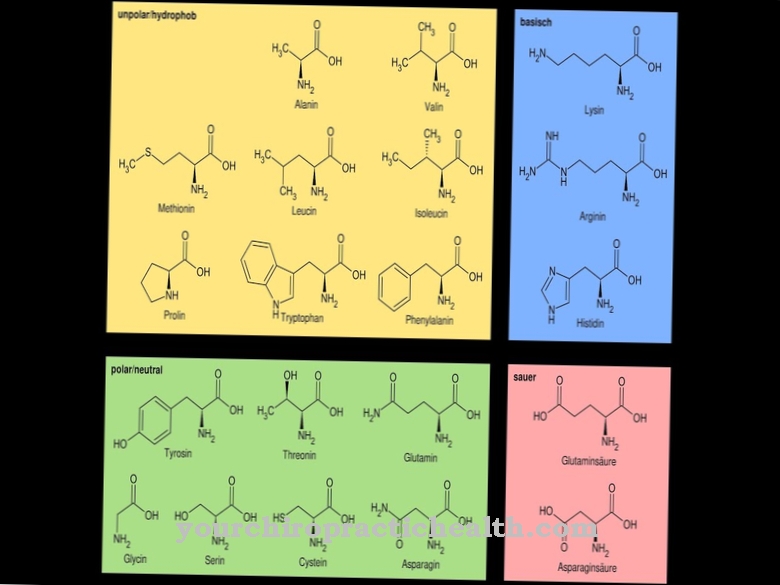
Дехидрогеназите са група, съставена от множество специализирани ензими. Отделните ензими имат различни задачи в човешкото тяло. Биологията разделя различните дехидрогенази на други подгрупи.
Алдехиддехидрогеназите (ALDH) например образуват група дехидрогенази, които се намират главно в черния дроб. По правило ALDH е отговорен само за определен субстрат и не може да допринесе за окисляването на други субстрати. Например, ALDH1A1, -1A2 и -1A3 обработват ретината, която се намира във витамин А. Има обаче изключения от това правило: ALDH2, например, може да работи с различни субстрати и не се ограничава до едно вещество.
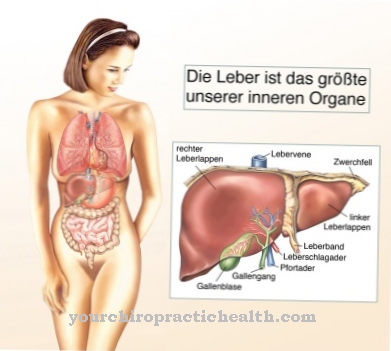
В черния дроб дехидрогеназите разграждат алкохола, например етанола. Те помагат за прочистването на кръвта, което е една от най-важните задачи на черния дроб. Молекулата на етанола първо се свързва към активния център на алкохолна хидрогеназа (ADH). С помощта на ензима етанолът се окислява, като разделя отрицателно заредения водороден атом и го предава на своя кофактор NAD +: По този начин ADH превръща етанола в ацеталдехид. Ацеталдехидът или етаналът е токсичен и причинява редица здравословни неразположения.
Храната обикновено съдържа само малко количество етанол, който тялото може да преобразува бързо. Следователно етаналните количества са само малки. Ацеталдехидът от своя страна е субстратът за ALDH ALDH катализира превръщането на ацеталдехид в оцетна киселина, преди оцетната киселина да бъде допълнително разцепена и разградена на вода и въглероден диоксид. В тази форма молекулите са напълно безобидни.
Образование, възникване, свойства и оптимални стойности
Дехидрогеназите се намират най-вече в течните части на клетъчната плазма или в митохондриите. Телата на жената произвеждат по-малко ADH от мъжете. Това допринася за факта, че жените са средно по-чувствителни към алкохола.
Точните стойности на различните дехидрогенази варират не само между различните ензимни групи, но и между различни индивиди и етнически групи. В Източна Азия и сред коренното население на Америка и Австралия нивата на ADH са средно по-ниски, отколкото например при европейците. Човешкият геном има 19 известни гена, които определят ALDH. Тези гени са на дванадесетата хромозома. Те определят кой ред приемат аминокиселините в протеиновите вериги.
Свойствата на протеиновите структури са резултат от тази последователност. Формата на дехидрогеназите и по този начин тяхната функция също зависи от последователността на аминокиселините по време на синтеза. Например ALDH2 се състои от 500 аминокиселини. По правило клетките синтезират дехидрогенази, от които по-късно също се нуждаят; Това означава, че няма нужда от транспортиране на веществата.
Болести и разстройства
Когато алкохолът се разгражда в човешкото тяло, ацеталдехидът се образува като междинен етап. Веществото е отровно; следователно ензимът ALDH трябва да го превърне в оцетна киселина възможно най-бързо. При по-големи количества алкохол обаче това обикновено не работи напълно. Затова махмурлукът се задържа няколко часа след консумация на алкохол.
Медицината също го нарича Veisalgia. Типични симптоми са главоболие, неразположение, мърдане в стомаха, повръщане и загуба на апетит. Способността за концентрация и реакция често е ограничена. Колко чувствителни са хората към алкохола, наред с други неща, зависи от това колко дехидрогенази произвеждат чернодробните клетки. Дехидрогеназите също играят роля в развитието или поддържането на различни заболявания. Мастната алдехидна дехидрогеназа (FALDH) например играе централна роля в развитието на синдрома на Sjogren.
Основните симптоми на клиничната картина са умствена изостаналост и прогресираща спастична параплегия. Спастичната параплегия е невродегенеративно заболяване и се характеризира със спастична парализа в краката. Синдромът на Sjögren-Larsson също означава, че роговият слой на кожата е по-силно изразен и образува ясно видими кожни люспи (ихтиоза). В допълнение към тези три кардинални симптоми, нарушенията на ретината са чести. Причината за синдрома се крие в гените, които кодират FALDH. Поради мутация тялото не правилно синтезира ензимния комплекс с FALDH. В резултат на това концентрацията на мастни алкохоли и мастни алдехиди в кръвната плазма се увеличава.


.jpg)


.jpg)









.jpg)