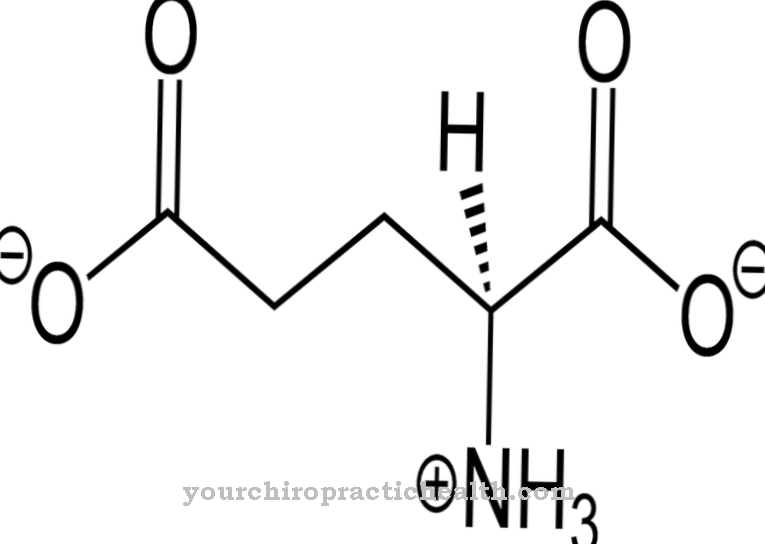
Desmosin е протеиногенна аминокиселина. Заедно с други аминокиселини, той образува фибри и структурен протеин еластин. С мутациите в ELN гена се нарушава структурата на еластина.
Какво е десмозин?
Аминокиселините са важна част от човешкия организъм. Те са клас органични съединения, които се образуват от поне една карбокси група и една амино група. Следователно аминокиселините са както карбоксилни киселини, така и амини.
В зависимост от позицията им по отношение на карбокси групата, аминокиселините могат да бъдат причислени към различни групи. Аминокиселините с терминална карбокси група се наричат геминални или α и се броят сред α-аминокиселините. Тези аминокиселини са елементи на протеини. Човешкото тяло има повече от 20 протеиногенни аминокиселини и 400 непротеиногенни аминокиселини. D-аминокиселините са специална група. Една от повече от 20 протеиногенни аминокиселини е десмозин, който заедно с подобно изградения изодесмозин образува фибриновия протеин еластин.
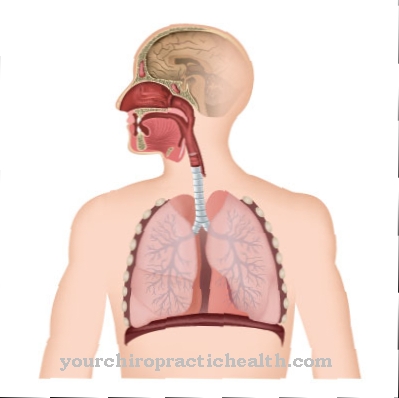
Еластинът и неговият разтворим прекурсор тропоеластин принадлежат към структурните протеини и допринасят за оформянето и задържането на анатомичните структури. Еластинът играе специална роля в способността на големите кръвоносни съдове да се разтягат, например аортата.
Функция, ефект и задачи
Десмозин формално е четворна аминокиселина. Той има пиридиниев пръстен в центъра. Пиридинът е химично съединение с емпиричната формула C5H5N, което може да бъде причислено към хетероцикличните родителски системи и образува най-простия азин под формата на шестчленен пръстен с един азотен атом и пет въглеродни атома.
Благодарение на централния си пиридиниев пръстен, дезмозинът може да свързва отделните протеинови нишки в еластина от фибри протеин. Съставът на еластин е подобен на този на колаген. Вместо хидроксилизин обаче, еластинът има значителна част от валин. Остатъците от лизин се окисляват до ализин от ензима лизил оксидаза. Три ализина и един лизин от своя страна образуват десмозин под формата на пръстен. Тази форма играе значителна роля в еластичността на цяла еластинова молекула.
Като протеинова мрежа, еластинът се състои от свързани с десмозин единици и еластично разтеглив. Белите дробове, както и кожата и кръвоносните съдове зависят от еластин и неговия компонент десмозин, тъй като това е единственият начин те да получат значителната си еластичност. Десмозинът флуоресцира синьо под ултравиолетова светлина и придава на еластин жълтия си цвят, неразтворимостта във вода, топлинната стабилност и устойчивостта на алкали и протеази.
Образование, възникване, свойства и оптимални стойности
Образуването на дезмозин е известно още като биосинтеза на десмозин. По време на тази биосинтеза крайните аминогрупи на L-лизинните единици се превръщат в ω-алдехиди от ензима лизил оксидаза чрез окисляване.
Лизил оксидазата е протеин лизин 6 оксидаза и съответства на ензим, който се среща в извънклетъчното пространство на съединителната тъкан. При кръстосаното свързване на еластин и колаген той служи като катализатор и механичен стабилизатор на протеините. По време на биосинтезата на десмозин лизил оксидазата превръща лизин в ализин. Този процес протича в извънклетъчната матрица и стабилизира кръстосаните връзки между колаген и еластин. От химическа гледна точка реакцията съответства на окислително дезаминиране до образуване на алдехид. Ализинът образува или алисиналдол или десмозин с алдехидни остатъци от съседните молекули на тропеластин чрез кондозация на алдол.
Оставащият лизин образува база на Шиф чрез своята аминогрупа и създава изодесмозин. Освен кръвоносните съдове, белите дробове и кожата, всички микрофибрили по-специално носят десмозин. Това са най-малките влакна от колагенна, ретикуларна и еластична тъкан.
Болести и разстройства
Образуването на еластин от компоненти като десмозин се нарушава при различни заболявания. Тези заболявания включват предимно мутации в ELN гена. Най-важните от тях са дерматохалазата, синдромът на Уилямс-Берен и субвалвуларната вродена аортна стеноза. Дерматохалазата е група от промени в съединителната тъкан с фамилно натрупване.
Характерно за тази група е увисналата, по-малко еластична и набръчкана кожа на различни части на тялото. ELN гена кодира еластин и може да причини такива симптоми чрез мутация. Синдромът на Уилямс-Берен е доста рядък в сравнение с това, като засяга само едно на 20 000 новородени. Заболяването се причинява от дефект върху седем хромозома. Локусът на гена е 7q11.23. Поради дефект в този момент, засегнатото лице липсва еластиновия ген и съседните гени. Изтриването на еластиновия ген причинява лицев дисморфизъм и нарушения в структурата на вътрешните органи. Сърдечни дефекти като суправалвуларна аортна стеноза и бъбречни малформации като бъбрек на подкова или бъбречна съдова стеноза могат да доведат. Освен това често има когнитивни увреждания.
Умствените способности на засегнатите са под средното. Въпреки словесната изразителност, те най-вече образуват изречения с малко съдържание. Те започват да четат в изключително ранна възраст, което често надценява умствените им способности. В допълнение към хиперлексията, перфектният им терен често води до надценяване. Като форма на еластинова мутация, субвалвуларната вродена аортна стеноза съответства от своя страна на сърдечна малформация, свързана със стесняване на основната артерия. Суправалвуларната стеноза лежи над аортната клапа в началото на аортата.
Тази форма на сърдечния дефект често се характеризира със стеснения във формата на часовници, които лежат над изхода на коронарните съдове. Възходящата част на аортата също може да бъде стеснена. Тази форма на аортна стеноза се среща особено често в контекста на току-що обсъдения синдром на Уилямс-Берен. Този сърдечен дефект вече е наблюдаван независимо от заболяването. В този случай обаче не е задължително да е свързана с мутация в еластиновия ген.



.jpg)


.jpg)









.jpg)