Най- Enteropeptidase е ензим на дванадесетопръстната лигавица, чиято функция е да активира ензимите на панкреаса. Той стои в началото на цяла каскада за активиране на храносмилателни ензими. Дисфункцията на ентеропептидазата води до неправилно храносмилане и неправилно усвояване на храната в тънките черва.
Какво е ентеропептидаза?
Ентеропептидаза е ензим на дванадесетопръстната лигавица, който активира храносмилателните ензими на панкреаса чрез активиране на трипсиноген към трипсин.
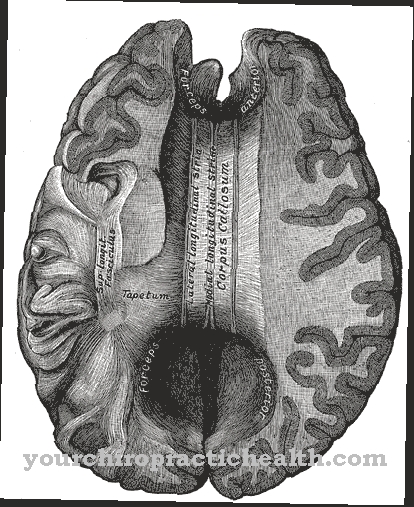
Ентеропептидазата се секретира в границата на четката на дванадесетопръстната лигавица. По-специално, жлезите на liebekühn са отговорни за секрецията. Жлезите на liebekühn представляват тръбни депресии в тънкия и дебелия чревен епител. В тънките черва те са разположени между тънките чревни ворсинки. Жлезите, известни още като криптове на Либеркюн, отделят голям брой ензими в допълнение към ентеропептидазата. Секрецията на ентеропептидаза се стимулира, когато химусът, който е предварително усвоен в стомаха, навлезе в дванадесетопръстника. Ензимът сам по себе си не влияе на хранителните компоненти.
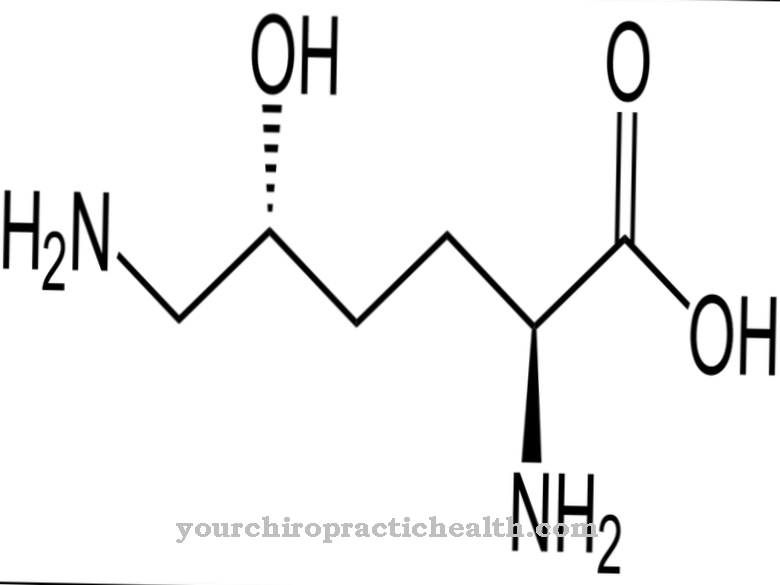
Само активирането на ензима трипсин настройва цялата каскада на активиране на храносмилателните ензими в движение. Ентеропептидазата, като трипсин и другите протеази на панкреаса, е серинна протеаза. Активният център съдържа каталитичния триад на аспарагинова киселина, хистидин и серин. Като ендопептидаза, ентеропептидазата разцепва протеините само в определени характерни точки с определени мотиви за разпознаване в аминокиселинната последователност. Ензимът винаги се разцепва по мотива за разпознаване Asp-Asp-Asp-Asp-Lys. С трипсиноген хексапептидът Val- (Asp) 4-Lys се разцепва, като се формира трипсин.
Функция, ефект и задачи
Функцията на ентеропептидазата е да активира храносмилателните ензими в панкреаса. Той само инициира първата стъпка на активиране с превръщането на трипсиноген в трипсин.
Трипсинът от своя страна е серинова протеаза, която разцепва протеините въз основа на същия характерен мотив за разпознаване. Сега продължава активирането на самия трипсиноген. В същото време той активира други панкреатични ензими от съответните им прекурсори като химотрипсиноген, проеластаза, прокарбоксипептидаза, профосфолипаза и проентеропептидаза. Ентеропептидазата също първоначално е в неактивната форма. Когато химусът навлиза в дванадесетопръстника, се секретира не само проентеропептидаза, но и дуоденаза, което активира проформата на ентеропептидазата. След старта на активационната каскада трипсинът поема активацията на всички панкреатични ензими, включително проентеропептидаза и трипсиноген.
Активирането на проентеропептидаза към ентеропептидаза се осъществява дори по-ефективно чрез действието на трипсин, отколкото чрез дуоденаза. Първичното присъствие на храносмилателните ензими в неактивната им форма е изключително важно. Действието на протеазите в частност е неспецифично. Всички протеини, които съдържат характерния мотив за разпознаване в молекулата, се хидролитично разцепват. Ако ензимите бяха каталитично активни незабавно, собствените протеини на организма вече биха се усвоили в панкреаса и панкреатичния канал. В резултат панкреасът би се разтворил сам. Активирането се извършва само в дванадесетопръстника извън екзокринните жлези.
Ензимите могат да започнат тук да разграждат хранителните компоненти, без да атакуват собствените тъкани на организма. За да се предотврати преждевременното активиране на ензимите, в канала на панкреаса работи допълнителен инхибитор на трипсина. Ключовата роля за храносмилателната каскада обаче играе трипсинът. След като този ензим се активира, активирането на всички храносмилателни ензими, включително ентеропептидазата, не може да бъде спряно.
Образование, възникване, свойства и оптимални стойности
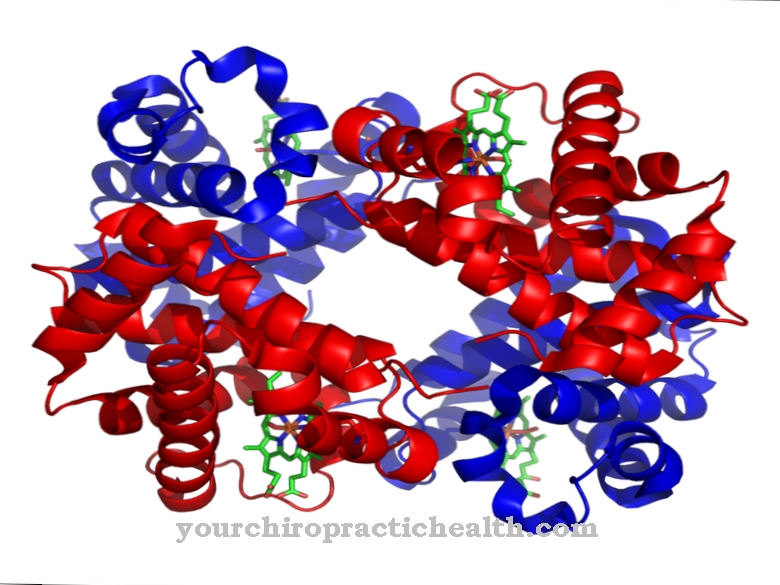
Подобно на всички серинови протеази, ентеропептидазата също има неспецифичен ефект и разцепва протеините, като използва характерен мотив за разпознаване. Ентеропептидазата се състои от лека и тежка верига, които са свързани чрез дисулфидни мостове. Доменът на серин протеаза е разположен върху леката верига.
Тежката верига има молекулна маса от 82 до 140 килодалтона, като молекулната маса на леката верига е от 35 до 62 килодалтона. Леката верижна структура на ентеропептидазата е подобна на другите серинови протеази трипсин и химотрипсин. Тежката верига е свързана с мембраната и влияе върху специфичността на ензима. Установено е, че изолираната лека верига има подобен ефект срещу характерния мотив за разпознаване - (Asp) 4-Lys-, но значително по-нисък ефект срещу трипсиноген.
Болести и разстройства
Човешката ентеропептидаза е кодирана от ENTK гена на хромозома 21. Мутация на този ген може да доведе до сериозни заболявания при засегнатите деца.
Ензимът вече не може да активира останалите храносмилателни ензими. Хранителните компоненти вече не се разграждат и поради това вече не могат да се абсорбират от тънките черва. На първо място става въпрос за неправилно храносмилане (недостатъчно разграждане), което води до неправилно усвояване на хранителните компоненти. Тялото вече не е достатъчно снабдено с хранителни вещества. Неуспехът да процъфтява, възниква задържан растеж и типични симптоми на дефицит на протеин с развитието на оток. В същото време, в допълнение към протеините, въглехидратите и мазнините се абсорбират слабо. Тъй като неразградените хранителни компоненти достигат до дебелото черво и се разграждат там чрез ферментация и гнилостни бактерии, се появяват метеоризъм, диария и коремна болка.
Досега са описани 15 случая на вродена недостатъчност на ентеропептидаза в световен мащаб. Симптомите на състоянието обаче са много по-чести. Дефицитът на ентеропептидаза не винаги трябва да присъства. Тъй като трипсинът играе ключова роля за активирането на храносмилателните ензими, дефект или дефицит на трипсин също води до подобни симптоми. Лечението на тези заболявания е едно и също и в двата случая. Ензимите се прилагат в активирана форма. Със сигурност има много повече недиагностицирани случаи на дефицит на ентеропептидаза.
Ако диагнозата е сигурна, ентеропептидазата също може да бъде заменена. Дефицитът на ентеропептидаза също се задейства вторично от тежки чревни заболявания.Заболявания като целиакия, съкратено тънко черво, недостиг на лактаза или други трябва да бъдат изяснени в диференциалната диагноза.

.jpg)








.jpg)