Около половината от всички протеини са в човешкото тяло Glycoproteins, Веществата играят роля като клетъчни компоненти, както и имунни вещества. Те се формират главно като част от така нареченото N-гликозилиране и могат да причинят сериозни заболявания, ако не са сглобени правилно.
Какво представляват гликопротеините?
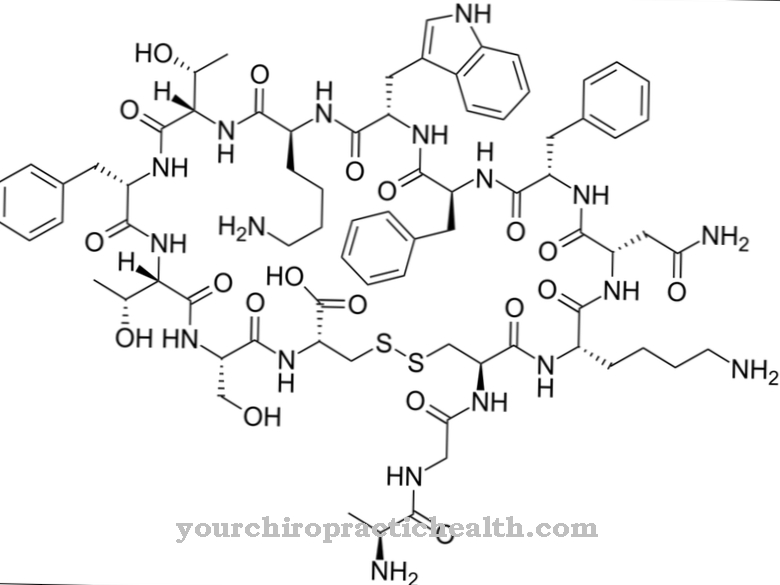
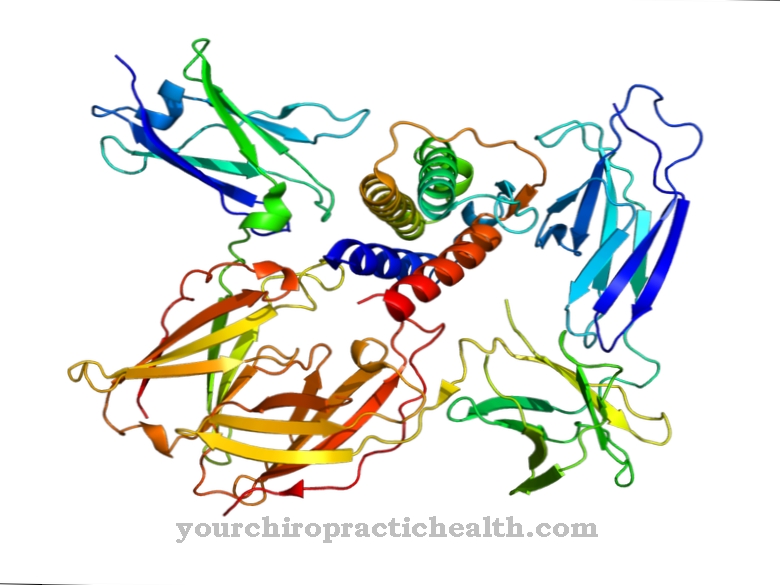
Гликопротеините са протеини с дървесни разклонени хетерогликанови остатъци. Те обикновено са с вискозна консистенция. Макромолекулите съдържат ковалентно свързани захарни групи.
Те се състоят от монозахариди като глюкоза, фруктоза, маноза или ацетилирана амино захар. Ето защо те са известни и като олигозахариди, свързани с протеини. Ковалентната връзка може да се осъществи по различни начини и съответства или на връзка с аминокиселините серин или аспарагин. Връзката със серина се нарича О- и тази за аспарагин N-гликозилиране. Гликопротеините, участващи в N-гликозилирането, варират по размер. Те съответстват на монозахариди, ди- или олигозахариди и дори полизахариди.
Според тяхното съотношение монозахариди те се делят на високоманозни, сложни и хибридни гликопротеини. В богатата на маноза група преобладават остатъците от маноза. В сложната група преобладават захаридите. Хибридната група е хибрид. Съдържанието на въглехидрати в гликопротеините е между няколко процента за рибонуклеази и до 85 процента за антигените на кръвната група.
Функция, ефект и задачи
Гликопротеините изпълняват множество функции в човешкия организъм. Те са структурен компонент на клетъчните мембрани и в този контекст се наричат също структурни протеини. Те също се намират в слуз и се използват като смазочни материали в течности.
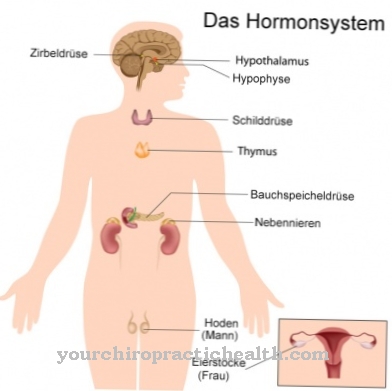
Като мембранни протеини те допринасят за взаимодействието на клетките. Някои гликопротеини имат и хормонални функции, като например растежния фактор hCG. Веществата са също толкова важни, колкото имунологичните компоненти под формата на имуноглобулини и интерферони. Всички експортни протеини и мембранни протеини на тялото все още са били гликопротеини, поне по време на биосинтеза. Те са особено подходящи за реакциите на разпознаване в имунната система, тъй като взаимодействат с имунологичните Т клетки и Т клетъчните рецептори. В човешката кръвна плазма са изолирани различни протеини от плазма, от които само албуминът и преалбуминът нямат остатъци от захар.
Изобилието от гликопротеини е невероятно. В крайна сметка почти всички извънклетъчно разтворими протеини и ензими съдържат остатъци от захар. Като хормони, гликопротеините имат плейотропен ефект и затова са от решаващо значение за дейността на различни органи на системата. Хормоните TSH, HCG и FSH са например гликопротеини. Като мембранни протеини те са представени в ролята на рецептори, както и преносители и стабилизатори. Те имат стабилизиращ ефект, особено заедно с гликолипидите. Заедно с тези вещества те образуват така наречения гликокаликс, който стабилизира клетките без клетъчна стена.
Образование, възникване, свойства и оптимални стойности
Най-честото образуване на гликопротеини е N-гликозидната връзка или N-гликозилирането към аспарагин. Захарта се свързва с амидните групи без азот. N-гликозилирането се извършва в ендоплазмения ретикулум. Така образуваните N-гликозиди са най-подходящата гликопротеинова група.
При N-гликозилиране захарният предшественик снотизира върху молекулата носител долихол, независимо от аминокиселинната последователност на целевия протеин. ОН групата в края на молекулата е свързана с дифосфат. В крайния фосфатен остатък на молекулите се образува олигозахариден предшественик. Първите седем от захарите се събират от цитозолната страна. Два N-ацетил-глюкозамини и пет остатъка от маноза са прикрепени към долихолфосфата. Като донори се появяват захарните нуклеотиди GDP-маноза и UDP-N-ацетил-глюкозамин. Прекурсорът се транспортира през ER мембраната чрез транспортен протеин.
Така предшественикът е ориентиран към вътрешността на ендоплазмения ретикулум, където към него се добавят четири остатъка от маноза. Освен това се отглеждат глюкозни остатъци. 14-те захарни прекурсора най-накрая се прехвърлят в протеин. Друг път за образуване на гликопротеини е О-гликозидната връзка или О-гликозилирането към серин, която се осъществява в апарата на Голджи на клетките. Захарта се свързва с хидроксилна група на серина. Стойностите на гликопротеините са особено важни по отношение на плазмените протеини, тъй като те играят роля в пълната кръвна картина. Изброяването на всички нормални стойности за гликопротеините поотделно в този момент би надхвърлило обхвата.
Болести и разстройства
Някои генетични заболявания имат ефект върху гликозилирането. Една група от такива заболявания е CDG. Гликопротеините показват анормални стойности. Засегнатите страдат от забавено развитие, което се отнася както до физически, така и до психически проблеми.
Щипка може да бъде друг симптом на генетичното разстройство. Общо около 250 различни гена участват в образуването на глокопротеини. В случай на вродени нарушения на гликозилирането, нарушенията в прикрепването на страничните вериги на въглехидратите към протеините се дължат на генетично разположение. В пост-транслационната модификация протеините получават пълната си функционалност. В този процес, когато ензимите или протеините, които изграждат въглехидратни странични вериги, са анормално събрани заедно, се създава CDG. N-гликозилирането е най-често засегнато от нарушения. Към днешна дата са открити около 30 ензимни дефекта, които оказват влияние върху N-гликозилирането.
Генетичните нарушения на O-гликозилирането са малко по-редки. Те се проявяват в невромускулни мултисистемни заболявания като синдром на Уокър-Уорбург. Тъй като гликопротеините поемат толкова много функции в организма, клиничната картина се характеризира с разнообразни симптоми. Всички системи на органи могат да бъдат засегнати от вродени нарушения на гликозилирането. Психомоторните нарушения в развитието са основният симптом. Неврологичните отклонения са също толкова често срещани. Коагулационните разстройства или ендокринните нарушения също не са рядкост.



.jpg)


.jpg)









.jpg)