Протеинът тропомиозина възниква предимно в набраздените мускули и участва в свиването на мускулите. Генетичните мутации могат да повлияят на структурата на произведените молекули на тропомиозин и по този начин да причинят редица заболявания - включително различни форми на кардиомиопатия, както и артрогрипозис мултиплекс конгенита и немалинова миопатия.
Какво е тропомиозин?
Тропомиозинът е протеин, който се намира в човешкото тяло предимно в скелетните мускули. Биохимикът Кенет Бейли за първи път описва протеина през 1946 г. Един мускул се състои от множество снопове мускулни влакна, които от своя страна се състоят от мускулните влакна.
Всяко влакно не е съставено от една, ясно дефинирана мускулна клетка, а от тъкан с много клетъчни ядра. В рамките на тези единици миофибрилите представляват по-фини влакна; техните напречни сечения се наричат саркомери. Саркомерът се състои от два вида кичури, които се редуват последователно една в друга, като зъбно колело или цип. Някои от тези направления са миозин, други са комплекс от актин и тропомиозин. В тази сложна молекула актин образува плътна верига, около която са навити две нишки тропомиозин.
Анатомия и структура
Тропомиозинът се състои от две части: α и β. Двата градивни елемента имат общо 568 аминокиселини, от които 284 са α-тропомиозин, а 284 са β-тропомиозин. Тези аминокиселини се подреждат подред и образуват дълги вериги, преди най-накрая да се съединят, за да образуват макромолекула във формата на прът.
Последователността на аминокиселините и структурата на протеина са генетично определени; при хората следните гени са отговорни за това: TPM1 на 15-та хромозома, TPM2 на 9-та хромозома, TPM3 на първата хромозома и TMP4 на 19-та хромозома. Нивото на тропомиозин (с двете субединици) се навива около по-дебелите актинови нишки в набраздените скелетни мускули. Към него се прикрепя и тропонин, друг протеин.
Функция и задачи
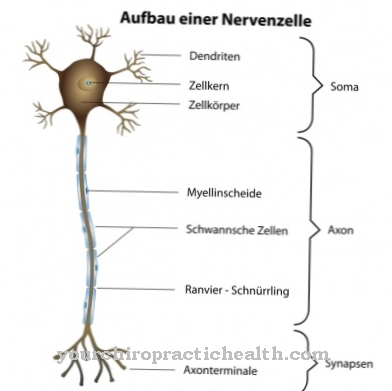
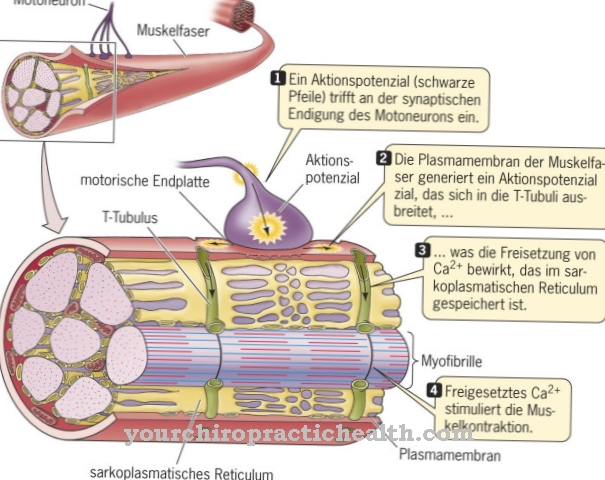
Tropomyosin е необходим, за да се свие скелетният мускул. Когато нервен импулс достигне мускула, електрическият стимул първоначално се разпространява през сарколемата и Т-тръбите и накрая води до отделяне на калциеви йони в саркоплазмения ретикулум.
Йоните се свързват временно с тропонина, който се намира на нивото на тропомиозина. В резултат на това калциевите йони променят физическите свойства на молекулата. Тропонинът се измества леко по повърхността и по този начин се отдалечава от местата, към които може да се свърже и миозинът. Миозинът образува комплементарните влакна към комплекса актин / тропомиозин. В края на миозиновата нишка има две така наречени глави. Миозиновите глави могат да се свързват с областите на актиновата нишка, които вече не са заети от тропонин.
След като се прикрепят към влакното, миозиновите глави се сгъват и се натискат между актиновите / тропомиозиновите нишки, което скъсява саркомера. В същото време този процес се случва не само в един саркомер, а в много. Поради това многобройните договорени саркомери предизвикват свиване на мускулните влакна и по този начин мускула като цяло. Нервният сигнал често стимулира няколкостотин мускулни влакна. Пластифициращият ефект на аденозин трифосфат (АТФ) позволява на миозиновата глава да се отдели от актина.
Контракцията на гладките мускули е малко по-различна. Гладките мускули заобикалят органи при хората или се намират в стените на кръвоносните съдове. Може да свива повече от набраздени мускули. Докато скелетните мускули имат набраздена структура, гладките мускули образуват равна повърхност, изградена от отделни клетки. В допълнение към актина и тропомиозина, гладките мускули имат калдесмон и калмодулин, два други протеина, взаимодействието на които влияе на напрежението в мускулите. Тропомиозинът действа предимно върху калмодулин.
В допълнение, тропомиозинът също играе роля в други биологични процеси. Например, изглежда, че влияе върху свързването на актина в цитоскелета и има ефект върху деленето на клетките.
заболявания
Едно заболяване, което може да е свързано с тропомиозин, е хипертрофична кардиомиопатия. Това е сърдечно заболяване, при което саркомерите (участъци от мускулните влакна) се сгъстяват, което се отразява и на дебелината на мускулните влакна като цяло.
В резултат на това могат да се развият симптоми като усещане за натиск в гърдите, замаяност, задух, синкоп и пристъпи на ангина. В този случай те се връщат към функционални проблеми на сърдечния мускул. Най-честата причина (40–60%) за хипертрофична кардиомиопатия се крие в гените: промените (мутациите) водят до грешки в генетичния код и съответно до неправилен синтез на протеини. Това може да повлияе и на различните протеини, които изграждат мускулни влакна.
При рестриктивна кардиомиопатия сърдечният мускул се втвърдява. Причината е излишък на съединителна тъкан. Рестриктивната кардиомиопатия води до сърдечна недостатъчност, която обикновено се характеризира с нарушения в дишането, оток, суха кашлица, умора, изтощение, замаяност, синкоп, сърцебиене и различни нарушения на храносмилането. Засегнатите са по-малко склонни да бъдат объркани, страдат от проблеми с паметта или нарушена когнитивна работа. Разширената кардиомиопатия може да се дължи и на грешка в гените на тропомиозин.
Когато се прояви това сърдечно заболяване, то често се свързва с глобална сърдечна недостатъчност и / или прогресираща лява сърдечна недостатъчност. Освен това могат да се появят нарушения на дишането, емболии и сърдечна аритмия. Две други заболявания, които могат да бъдат свързани с тропомиозин и частично се основават на мутации, са немалиновата миопатия, при която мускулите могат да бъдат увредени по много начини, и артрогрипозата мултиплекс конгенита, при която ставите се втвърдяват. Въпреки това, всички тези заболявания могат да имат и други причини, мутациите в гените на тропомиозин са само една възможност.







.jpg)

.jpg)