Лизил хидроксилази представляват група ензими, които са отговорни за хидроксилирането на лизиновите остатъци в протеините. Така те основно допринасят за структурата на съединителната тъкан. Нарушенията във функцията на лизил хидроксилазите се изразяват при заболявания като скорбут или наследствен синдром на Ehlers-Danlos.
Какво представляват лизил хидроксилазите?
Лизил хидроксилазите са ензими, чиято задача е да катализират пост-транслационната модификация на аминокиселината лизин чрез включване на хидроксилна група в хидроксил лизин. Това укрепва съединителната тъкан, тъй като нейните протеинови вериги имат възможност да се свържат допълнително чрез хидроксилните групи.
Човешката лизил хидроксилаза се състои от 727 аминокиселини. Лизил хидроксилазите също принадлежат към групата на хидроксилазите, т.е. ензимите, които обикновено катализират включването на хидроксилни групи в молекули. В допълнение към лизил хидроксилазите, хидроксилазите или оксидоредуктазите включват също пролил хидроксилази, фенилаланин хидроксилаза, тирозин хидроксилаза или триптофан хидроксилаза. Особено заедно с пролил хидроксилазите лизил хидроксилазите играят важна роля във функцията на съединителната тъкан. И двете ензимни групи се нуждаят от коензим витамин С за своята функция.
Функция, ефект и задачи
Функцията на лизил хидроксилазите се състои изключително в катализиране на включването на хидроксилни групи в лизинови остатъци в протеина. В хода на пост-транслационната модификация аминокиселината хидроксиламин се образува от лизин.
Въпреки че хидроксиламинът също е безплатен, той не може да бъде включен в протеина в тази форма. Следователно, след транслационната модификация означава последваща конверсия на тази аминокиселина след изграждането на протеина. Когато водородният атом се смени за хидроксилната група, в този момент в протеина е вградена функционална група, която може да изпълнява мостови функции. С помощта на хидроксилната група, различни протеинови вериги могат да се свързват заедно. Освен това молекулите на захарта могат да се свържат с тази функционална група. И двете реакции са много важни, наред с други неща, в развитието на съединителната тъкан.
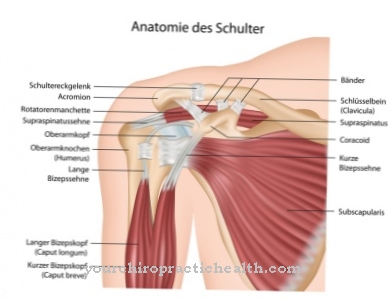
Съединителната тъкан обхваща организма и вътрешните органи. Тя трябва да бъде твърда и напрегната, за да може да прави разлика между функционално различните органи. Това се осигурява от протеините на съединителната тъкан, които съдържат висок процент аминокиселини лизин и пролин.За тази цел и двете аминокиселини впоследствие са частично модифицирани след включването им в протеина чрез добавяне на хидроксилна група. Както вече беше споменато, с пролин тази реакция се катализира от пролил хидроксилази, а с лизин - от лизил хидроксилази. След образуването на протеин, тези реакции на модификация създават мрежа от протеинови вериги, които представляват стегната съединителна тъкан.
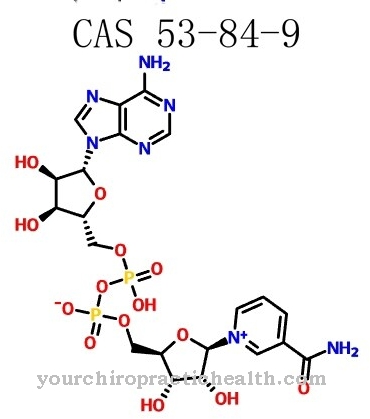
Без функцията на двата ензима, развитието на функционалната съединителна тъкан изобщо не би било възможно. И двата ензима обаче работят само с помощта на коензим аскорбинова киселина, т.е. витамин С. В случай на структурно променени ензими чрез мутация или липса на витамин С това може да доведе до нарушаване на структурата на съединителната тъкан и по този начин до сериозни заболявания.
Образование, възникване, свойства и оптимални стойности
Генът PLOD1 е отговорен за кодирането на човешката лизил хидроксилаза. Името PLOD1 произлиза от наименованието на лизил хидроксилаза "Prokollagen-Lysin, 2-Oxoglutarat-5-Dioxygenase 1". Този ген се намира на хромозома 1. Тъй като непрекъснато се произвежда нова съединителна тъкан, съществува и постоянна необходимост от производството на лизил хидроксилази. Мутация на този ген следователно може да има много сериозни последици за здравето на организма.
Болести и разстройства
Нарушенията във функцията на лизил хидроксилазите играят особено важна роля при скорбут и синдром на Ehlers-Danlos. Щервата е известна като древна морска болест, която се причинява от липса на витамин С. Витамин С, известен още като аскорбинова киселина, функционира като коензим от лизил хидроксилази и пролил хидроксилази. Ако той липсва, аминокиселините лизин и пролин в протеина на съединителната тъкан вече не могат да бъдат хидроксилирани.
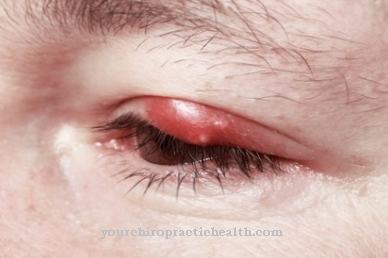
Тъй като има постоянно натрупване и разграждане на протеините на съединителната тъкан, протеиновите вериги са все по-малко способни да се свързват през периода на недостиг на витамини. Съединителната тъкан се разхлабва и вече не може да изпълнява правилно функцията си. Появяват се широк спектър от симптоми, включително общо изтощение, чувствителност към инфекция, кървене на венците, загуба на зъби, лошо зарастване на рани, тежки кожни проблеми, загуба на мускули и много други увреждания на здравето. В крайна сметка скорбут може да доведе до смърт от обща сърдечна недостатъчност или тежки инфекции. Древните мореплаватели били особено засегнати, тъй като не могли да получат достатъчно витамин С по време на дългите плавания в морето.
Доказано е, че болестта се лекува веднага, когато се дават определени храни като кисело зеле. Едва по-късно беше установено, че причината за заболяването е дефицит на витамин С. Избухването на скорбут от болестта на моряка по-късно беше предотвратено чрез хранене на моряците с кисело зеле. Друго заболяване, което може само частично да се дължи на дефект на човешката лизил хидроксилаза, е синдромът на Ehlers-Danlos. Синдромът на Ehlers-Danlos е събирателен термин за различни наследствени заболявания на съединителната тъкан с различни причини. Този синдром се характеризира с тежка слабост на съединителната тъкан.
Кожата е свръхтягаща, а ставите са преместваеми. Генетично модифицираната лизил хидроксилаза задейства синдрома на Ehlers-Danlos тип VI. Мутиран ген, наречен PLOD1, който се намира на хромозома 1, е отговорен за това. Дефектният ензим, образуван от това, вече не е напълно функционален и може само да катализира недостатъчно реакции на хидроксилиране на лизин. Развива се слаба съединителна тъкан с известните симптоми, както и допълнително засягане на очите и вътрешните органи. Синдромът на Ehlers-Danlos тип VI може да бъде наследен като автозомно-рецесивен признак.



.jpg)






.jpg)

.jpg)