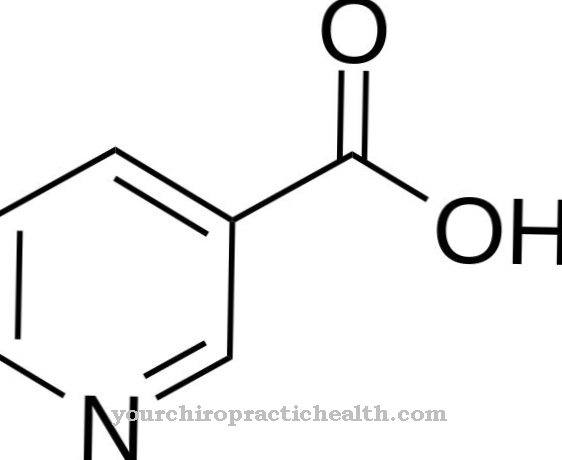
Лизил оксидаза е ензим на съединителната тъкан, който има каталитични задачи и насърчава кръстосаното свързване на колаген и еластин. Ензимът има стабилизиращ ефект върху съединителната тъкан, като извършва окислително дезаминиране и по този начин създава основните условия за омрежване. При Cutis laxa активността на лизил оксидазата е намалена.
Какво е лизил оксидаза?
В човешкото тяло има различни ензими, всички от които имат каталитична активност. Ензимите позволяват реакции в човешкото тяло или ги ускоряват. Лизил оксидазата е ензим, който се намира в съединителната тъкан на човека. Нарича се още протеин лизин 6 оксидаза и се намира главно в извънклетъчното пространство на съединителната тъкан.
Каталитичната активност на ензима в този случай се отнася до омрежването между колаген и еластин. Лизил оксидазата стабилизира двата протеина по механичен начин и по този начин дава възможност за реактивна връзка. Лизил оксидазата не се намира само в човешкото тяло. Други гръбначни животни също са снабдени с ензима. Лизил оксидазата се счита за стабилизатор на съединителната тъкан. Недостигът на ензима води до клиничната картина на cutis laxa, тежка и наследствена слабост на съединителната тъкан.
Функция, ефект и задачи
Лизил оксидазата поема важни задачи в извънклетъчното пространство в кръстосаната връзка между отделните молекули колаген. В човешкото тяло, колагенът играе основна роля в протеините, с около 30 процента от общата протеинова маса.
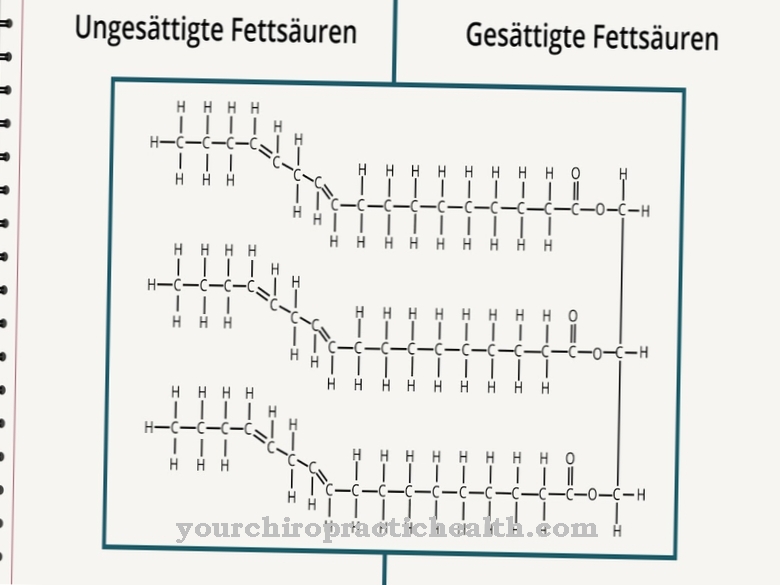
Колагенът е най-разпространеният протеин. Това е структурен и изграждащ протеин, който съставлява много компоненти на тялото, като съединителна тъкан, кости, зъби, хрущяли, сухожилия, връзки и кожа. Лизил оксидазата поддържа свързването на колаген с карбонилни групи и по този начин допринася за стабилността на споменатите компоненти на тялото. Той има каталитична активност за получаване на карбонилни групи, които образуват ковалентни кръстосани връзки върху колагени в кондолации на алдол. Следователно каталитичната задача на лизил оксидазата е да се подготви за образуването на фибрили. Ензимът създава всички химически условия, необходими за образуването.
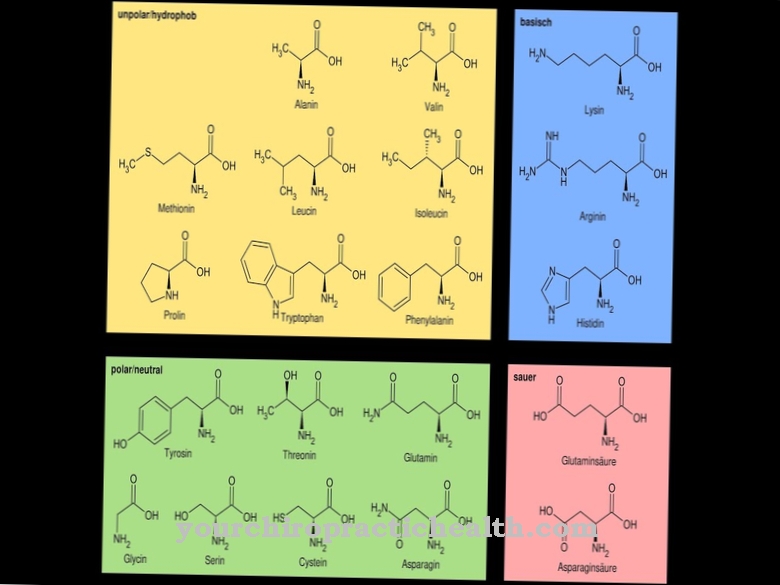
Фибрилите се считат за влакна от влакна. Те съответстват на тънки и влакнести части на тялото и се намират в растителните клетъчни стени, в човешките мускули и в съединителната тъкан. Задачата на лизил оксидазата в този контекст е по същество окислителното дезаминиране на лизиловите остатъци. В химията дезаминирането е химическо разделяне на амино групи като амониеви йони или амоняк. Окислителното дезаминиране разделя аминогрупите на аминокиселината L-глутамат от водорода и ги окислява до имино групи с прехвърлянето на водород към NAD + или NADP +.
Това е последвано от хидролитично разцепване на имино групите като амониеви йони, което е свързано с образуването на α-кетокиселина. Дезаминирането съответства на първата стъпка в биохимичния разпад на аминокиселините, която при бозайниците се осъществява главно в черния дроб. Амониевият йон, образуван по време на дезаминиране, се превръща в урея. Процесите на дезаминиране на лизил оксидазата пораждат алдехидни групи, които заедно с отделните амино групи на други лизилови остатъци пораждат така наречените основи на Шиф и по този начин могат да образуват стабилизиращите кръстосани връзки в колагена.
Образование, възникване, свойства и оптимални стойности
Лизил оксидазата в ДНК е кодирана от гена LOX, който при хората е разположен върху хромозома 5 в локуса на гена q23.3 до q31.2. Генният продукт не е окончателната форма на ензима. Продуктът не е завършена лизил оксидаза, а предшестваща форма, която след превода има моларна маса от 47 kDa.
При по-нататъшния ход настъпва гликозилация. По време на този процес, моларната маса на по-късния ензим нараства до 50 kDa и предшествената форма на лизил оксидаза се секретира в извънклетъчното пространство. След секрецията, пре-про-лизил оксидазата се обработва допълнително. Веществото се разделя в извънклетъчното пространство. Протеин 1 е отговорен за разделянето на два фрагмента. По този начин от една страна се получава 32 kDa лизил оксидаза. От друга страна се създава остатъчно вещество, което в този случай съответства на полипептид.
Болести и разстройства
Генетичните дефекти в лизил оксидазата могат да причинят клиничната картина на кутикс лакса. Това заболяване се нарича още дерматохалаза и се отнася до група често свързани с възрастта слабости в съединителната тъкан, които в повечето случаи се наблюдават с фамилно натрупване.
Общата характеристика на всички явления на дерматохалазата е увиснала и нееластична кожа, която често увисва в големи гънки на различни части на тялото. Повечето от засегнатите изглеждат по-стари, отколкото са поради промените. Заболяванията се причиняват, наред с други неща, от генетични мутации. В този контекст говорим за синдром на cutis laxa. Заболяването може да съществува в автозомно рецесивни, автозомно доминантни и х-хромозомни форми. В много случаи синдромът на cutis laxa се свързва с други аномалии и, ако органите са замесени, например, може да бъде фатален.
ARCL1 съответства на cutis laxa от автозомно рецесивен тип 1 и се счита за най-тежката форма, която при определени обстоятелства може да доведе до животозастрашаващи усложнения. Формата ARCL1A е свързана с мутации в FBLN5 гена в локус 14q32.12. Тип ARCL1B е свързан с мутации в гена EFEMP2 в локус 11q13.1, а вариант ARCL1C съответства на cutis laxa със съпътстващи аномалии в белия дроб, стомашно-чревния и пикочния тракт, които се дължат на мутации в LTBP4 гена в локус 19q13.2.
Мутациите в споменатите гени водят до под средната активност на ликсилоксидазата. Недостатъчните кръстосани връзки се създават поради намалената активност на ензима. Съединителната тъкан на пациента не е достатъчно стабилизирана.


.jpg)




.jpg)