Най- Предизвикано-добре-Теорията се връща към Кошланд и съответства на разширяване на принципа за заключване на ключ, който се основава на точността на прилягане на анатомични структури. Индуцираното прилягане се отнася до ензими като киназа, които променят конформацията си, за да образуват ензимно-лиганд комплекс. В случай на ензимни дефекти принципът на индуцирано прилягане може да бъде повлиян от нарушения.
Какво представлява индуцираното приспособление?

Много процеси в тялото работят на принципа за заключване на ключ или ръка за ръкавица. Това се отнася например за съчленени връзки. Ставната глава се захваща в гнездото на ставата като ключ в ключалка или ръка в ръкавица. Вратата се отваря само когато ключът е точно в ключалката. В същия контекст определени функции на тялото се отварят само когато структурите се срещат точно.
Индуцираното напасване е специална форма на принципа за заключване на ключ. Това е теория за образуването на протеино-лигандни комплекси, например ензимно-субстратен комплекс в контекста на ензимно-катализирани реакции.
Даниел Е. Кошланд се счита за първият, който описва теорията и за първи път я постулира през 1958 г. За разлика от принципа на заключване на ключ, теорията за индуцирано прилягане не предполага две статични структури. По-специално в случая на протеино-лигандните комплекси, конформационната промяна на белтъка, който участва, трябва да даде възможност за образуване на комплекса. Лиганд и протеин, или по-скоро ензим, Кошланд разглежда като динамичен и говори за взаимодействие, което движи и двамата партньори към промяна в конформацията в името на образуването на комплекс.
Функция и задача
Между ензимите и субстратите има специфичност на свързване. Тази специфичност на обвързване предполага принципа на заключване на ключ. Всеки ензим има активен център. За сложно образуване с лиганд, този център е точно оформен по такъв начин, че почти перфектно да съответства на пространствената форма на предвидения субстрат.
В случай на много ензими обаче активният център във всеки случай е във форма, която не е много точна, стига да не е свързана с субстрат. Това наблюдение изглежда противоречи на принципа за заключване, защото ензимите и техните лиганди първоначално изглежда адаптират формата си.
Веднага след като ензимът се прикрепи към лиганд, се създават междумолекулни взаимодействия. Тези взаимодействия на междумолекулно ниво водят до промяна в конформацията на ензима. Под конформация се разбира различните възможни разположения на отделни атоми в молекула, които са резултат от обикновено въртене около ос. Промяната в конформацията на ензимите съответства на промяна в пространственото разположение на техните молекули и дава възможност само за образуване на ензимно-субстратен комплекс.
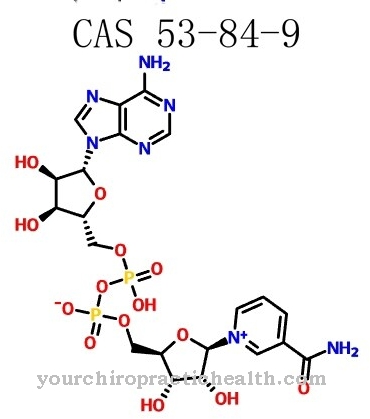
Хексокиназата като ензими катализира например първия етап на гликолизата. Веднага след като тези ензими влязат в контакт с субстратната глюкоза, може да се наблюдава индуцирано напасване в смисъл на образуване на "индуциран припадък". Ензимът хексокиназа фосфорилира лигандната си глюкоза чрез консумация на АТФ за образуване на глюкозо-6-фосфат.
Структурата на водата наподобява тази в алкохолната група на атома С6, която ензимът фосфорилира по време на реакцията. Поради малкия размер водните молекули могат да се прикрепят към активния център на ензима, така че да се генерира хидролиза на АТФ. Въпреки това, индуцираното прилягане позволява на хексокиназата да катализира преобразуването на глюкоза с висока специфичност, така че хидролизата на АТФ трябва да се проведе в малка степен. С механизма на индуцирано прилягане специфичността на субстрата се увеличава.
Принципът в човешкия организъм може да се спазва особено при кинази. Индуцираната адаптация не се прилага за всеки лиганд-рецепторен комплекс, тъй като конформационната промяна на двамата партньори в много случаи е естествена граница.
Болести и неразположения
Принципът на индуцирано прилягане е нарушен в случай на различни ензимни дефекти. При фенилкетонурия например ензимите са ограничени в своята активност или напълно се провалят. Обикновено това се дължи на генетичен дефект. При фенилкетонурия ензимът фенилаланин хидроксилаза е дефектен. Фенилаланинът вече не се превръща в тирозин и се натрупва съответно. Възникват невротоксични вещества, така че освен психични увреждания, пациентът има склонност към спазми. Ензимните дефекти обикновено са генетични и са причинени от неправилно кодирана последователност на аминокиселини в ДНК.
Метаболитните заболявания, причинени от ензимни дефекти и такъв нарушен принцип на индуцирано прилягане, са известни като ензимопатии. Дефектите на пируват киназа присъстват например в неправилно кодиращ PKLR ген. Този ген се намира на генния локус 1q22 на хромозома 1. Известни са различни мутации на PKLR алела на пируват киназа, които се проявяват като дефекти в R-формата.
Болестта на Херс отново се нарича гликогеноза тип VI и принадлежи към групата на гликогенните заболявания. Това е автозомно рецесивно или Х-свързано метаболитно разстройство поради ензимни дефекти. По-точно причината се крие в различни ензимни дефекти в системата на фосфорилаза киназа в черния дроб и мускулите. В този контекст например са известни дефицитът на свързана с X фосфорилаза-Ь-киназа в черния дроб, дефектът на чернодробна фосфорилаза от автозомно-рецесивно наследяване и комбинираната недостатъчност на фосфорилаза-Ь-киназа в черния дроб и мускулите.
Във връзка с чернодробна фосфорилаза причинителните мутации бяха локализирани върху PYGL гена и следователно са на хромозома 14q21 до q22. Комбинираният дефицит на фосфорилаза в чернодробната мускула е свързан с мутации в PHKB гена в локус 16q12-q13. Причинителни мутации в гена на PHKA2 в локус Xp22.2-p22.1 бяха идентифицирани за свързания с X дефект в чернодробната фосфорилаза киназа. Други гликогенози също могат да отменят индуцирания ефект на съответната киназа или да я затруднят.











.jpg)

.jpg)